Artykuł eksperta Urtiki: Leki sieroce i ich dostępność w Polsce
Leki sieroce i ich dostępność w Polsce
W artykule przedstawiona została problematyka chorób rzadkich, obecny poziom dostępności leków sierocych w Polsce oraz problemy, z jakimi mierzą się sektor prywatny, oraz publiczny przy wprowadzaniu na rynek nowych terapii.
Każdego roku na całym świecie w ostatni dzień lutego obchodzony jest Dzień Chorób Rzadkich, mający na celu podniesienie świadomości o tych schorzeniach i ich wpływie na życie, zarówno wśród ogółu społeczeństwa, jak i osób mających wpływ na funkcjonowanie systemu ochrony zdrowia. Za chorobę rzadką uznaje się schorzenie, na które cierpi nie więcej niż 5 na 10000 osób [1]. Choroby te są różnorodne pod względem przyczyn, objawów i rokowań.
Zdecydowana większość z nich ma podłoże genetyczne, ale mogą być również powodowane przez infekcje, alergie czy czynniki środowiskowe. Według danych Europejskiej Organizacji ds. Chorób Rzadkich, istnieje około 6 – 8 tys. takich chorób i są to najczęściej ciężkie, często zagrażające życiu schorzenia [1]. Szacuje się, iż w całej Unii Europejskiej jest około 30 milionów pacjentów dotkniętych chorobami rzadkimi, z czego w Polsce choruje na nie około 2 – 3 mln osób [1] [2].
Ze względu na rzadkość występowania choroby te stanowią poważne wyzwanie zarówno dla sektora farmaceutycznego, który pracuje nad rozwojem nowych terapii, jak i ochrony zdrowia, który powinien zapewnić skuteczną diagnostykę chorób rzadkich i dostęp do innowacyjnych leków. Przyjrzyjmy się temu dokładniej.
Rozwój leków dla chorób rzadkich
Proces rozwoju nowego leku oraz wprowadzenia na rynek jest długim, kosztownym i ryzykownym przedsięwzięciem. Trwa on średnio 14 lat i może pochłonąć ponad 8 mld PLN, a prawdopodobieństwo przejścia „kandydata” na lek przez badania kliniczne i dotarcia do momentu wprowadzenia na rynek często nie przekracza 10% [3] [4]. To w pewnej mierze uzasadnia wysoki koszt terapii innowacyjnych. Opracowanie leku przeznaczonego do leczenia choroby rzadkiej z uwagi na małą liczbę pacjentów nie pozwala na zwrot kosztów zainwestowanych w badania.
Dlatego też w Unii Europejskiej (oraz w Stanach Zjednoczonych) stworzono system zachęt wspierających prace rozwojowe i procedurę rejestracji tych leków. Na przykład, podmiot pracujący nad lekiem na chorobę rzadką, przy spełnieniu rygorystycznych wymogów, może uzyskać status „leku sierocego”. Pozwala to na redukcję opłat administracyjnych, zwolnienia z części procedur oceny, 10-letni okres wyłączności rynkowej po wydaniu zezwolenia, a także wsparcie merytoryczne, w tym dialog z organem regulacyjnym na wczesnym etapie rozwoju leku [6].
Powyższe mechanizmy przyczyniły się do gwałtownego wzrostu badań nad chorobami rzadkimi oraz pojawienia się większej liczby nowych leków. Tylko w ubiegłym roku (2022) w Unii Europejskiej do obrotu zostało dopuszczonych 30 leków dedykowanych chorobom rzadkim, z których 80% miało status leku sierocego (Rycina 1). Duża część z nich (30%) przeznaczona jest chorom onkologicznym, w tym szpiczakowi mnogiemu (m.in.: Carvykti, Pepaxti, Tecvayli, Thalidomide Lipomed), chłoniakom (m.in.: Breyanzi, Lunsumio) oraz innym nowotworom.
Kolejnym dużym obszarem terapeutycznym są różnego rodzaju wady wrodzone i choroby dziedziczne – w 2022 roku zostało zarejestrowanych w tym obszarze 5 nowych produktów leczniczych. Stosowane są one w przypadku niedoborów kinazy pirogronianowej (Pyrukynd), dekarboksylazy L-aminokwasów aromatycznych (Upstaza) i kofaktora molibdenu typu A (Nulibry), a także w leczeniu zespołu progerii Hutchinsona-Gilforda (Zokinvy) i ran o częściowej grubości związanych z postacią dystroficzną pęcherzowego oddzielania się naskórka i postacią graniczną pęcherzowego oddzielania się naskórka (Filsuvez). Spośród innych leków dopuszczonych do obrotu warto również wymienić Xenpozyme stosowany w leczeniu objawów niedoboru kwaśnej sfingomielinazy typu A/B lub B oraz Livmarli wskazany do stosowania w leczeniu świądu w przebiegu cholestazy u pacjentów z zespołem Alagille’a. Tymi preparatami mogą być leczone zarówno dzieci jak i dorośli.
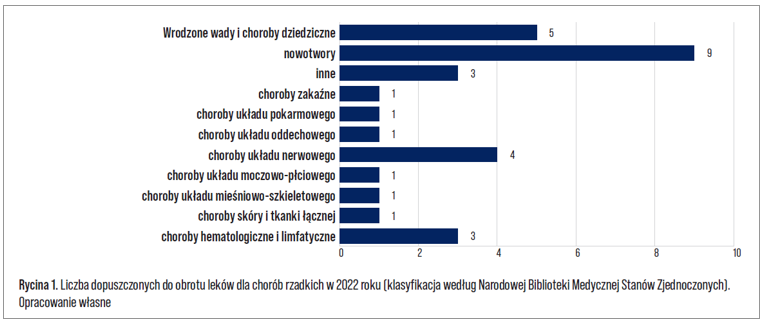
Na dziś Komisja Europejska zarejestrowała ponad 400 leków przeznaczonych do leczenia pacjentów cierpiących na choroby rzadkie, przy czym około 150 leków ma desygnację leku sierocego. Należy jednak podkreślić, iż nie oznacza to automatycznie pozytywnej decyzji refundacyjnej, a tym samym dostępności leczenia dla chorych w danym kraju.
Refundacja leków sierocych w Polsce
Po uzyskaniu rejestracji, która dla leków sierocych obligatoryjnie odbywa się na poziomie europejskim, w celu uzyskania refundacji, posiadający pozwolenie na dopuszczenie do obrotu zwraca się do odpowiednich instytucji regulujących refundację we właściwym państwie członkowskim. Obecnie, w Polsce, refundowanych jest około 49 leków sierocych, czyli 1/3 wszystkich zarejestrowanych leków sierocych w Unii Europejskiej (Rycina 2). Krajowa refundacja całkowicie pokrywa jedynie leczenie chorób układu sercowo – naczyniowego, gdzie na dziś zarejestrowany jest tylko jeden lek sierocy – Takhzyro.
Wskazany jest on do stosowania w ramach profilaktyki nawracających napadów dziedzicznego obrzęku naczynioruchowego u pacjentów w wieku 12 lat i starszych. Zadowalający poziom refundacji charakteryzuje również obszar onkologiczny. Pacjenci cierpiący na rzadkie nowotwory mają dostęp niemal do połowy innowacyjnych leków. Dotyczy to w dużej mierze leczenia szpiczaka plazmocytowego, różnego rodzaju chłoniaków oraz białaczek. Niesatysfakcjonujący poziom refundacji mają leki stosowane w przypadku rzadkich chorób układu mięśniowo-szkieletowego oraz chorób hematologicznych.
W tych obszarach terapeutycznych dostępnych jest około 40% zarejestrowanych leków sierocych. Dla przykładu, refundacją objęte zostało leczenie akromegalii, achondroplazji, dystrofii mięśniowej Duchenne’a, rdzeniowego zaniku mięśni jak również hemofilii typu A i B, hemoglobinurii, czy niedokrwistości hemolitycznej.
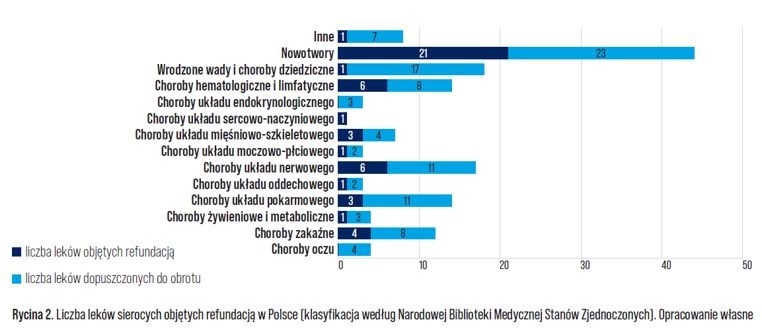
Wyraźne braki natomiast można zaobserwować w przypadku leczenia rzadkich chorób oczu (np. neurotroficzne zapalenie rogówki, dziedziczna dystrofia siatkówki), chorób układu endokrynologicznego (zespół Cushinga, niedoczynność przytarczyc) oraz wrodzonych wad, w tym cystynozy, hipofosfatazji, mukopolisacharydozy. W tych przypadkach liczba refundowanych leków sierocych jest znikoma.
Pod względem dostępności leków sierocych, Polska pozostaje daleko w tyle w porównaniu do największych państw członkowskich Unii Europejskiej. Na przykład w Niemczech refundowanych jest ponad 90% zarejestrowanych leków sierocych, we Francji – 80%, a we Włoszech około 60% [7]. Głównymi przyczynami odmowy refundowania leków sierocych są: niska jakość dowodów, brak jednoznacznych korzyści w zakresie klinicznie istotnych punktów końcowych, brak efektywności kosztowej leku, niepewność co do oszacowanej liczebności populacji oraz duże obciążenie budżetu płatnika publicznego w przypadku refundacji leku [8].
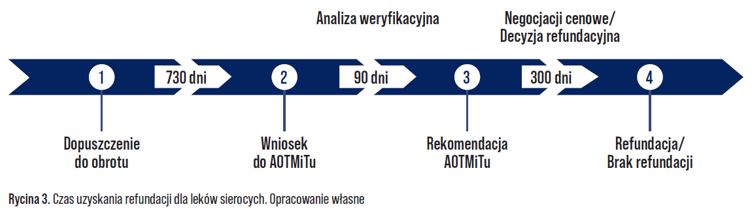
Należy również podkreślić, iż proces podejmowania decyzji refundacyjnej jest czasochłonny a zanim lek znajdzie się na liście refundacyjnej mogą minąć lata. Poślizg ten, w dużej mierze zależy jednak od państwa członkowskiego. W Niemczech opóźnienie pomiędzy scentralizowaną rejestracją a dostępnością handlową wynosi średnio 39 dni, we Francji – 573 dni, a we Włoszech 356 dni [7]. W Polsce mija średnio 1220 dni od chwili dopuszczenia do obrotu do momentu, w którym lek sierocy znajdzie się na liście refundacyjnej. W praktyce, oznacza to, że lekarz w Niemczech ma dostęp do leku i może go przepisać pacjentowi, podczas gdy lekarz w Polsce może czekać latami zanim będzie mógł przepisać ten sam lek swojemu pacjentowi.
Opóźnienie to jednak nie jest w całości spowodowane procesami biurokratycznymi, takimi jak analiza wniosków refundacyjnych (przez Agencję Oceny Technologii Medycznych i Taryfikacji) czy negocjacji cenowych z Ministerstwem Zdrowia (Rycina 3.). Istotną rolę odgrywa tu strategia wprowadzenia leków na rynek przez firmy. Z komercyjnego punktu widzenia producenci leków traktują priorytetowo rynki, na których liczba potencjalnych pacjentów jest największa lub na których istnieje większe prawdopodobieństwo uzyskania zgody na pożądaną cenę leku. Prowadzenie długotrwałych negocjacji cenowych we wszystkich krajach europejskich przekracza możliwości większości firm. Na rynku krajowym producenci średnio składają wniosek o refundację po 730 dniach od czasu rejestracji preparatu leczniczego.
Diagnostyka chorób rzadkich
Kolejnym ważnym problemem, który ogranicza dostęp pacjentów do leczenia to właściwe oraz terminowe rozpoznanie chorób rzadkich. Niezwykła różnorodność kliniczna tych chorób oraz rzadkość ich występowania stanowi duże wyzwanie dla lekarzy podstawowej opieki zdrowotnej oraz specjalistów, którzy w swojej dotychczasowej praktyce mogli nie spotkać się z chorobami rzadkimi. Problem ten jest potęgowany brakiem lub ograniczonym dostępem do współczesnych metod diagnostycznych.
Złotym standardem, w tym przypadku, jest diagnostyka genetyczna z zastosowaniem wysokoprzepustowych metod genomowych, takich jak aCGH (ang. array comparative genomic hybridization, porównawcza hybrydyzacja genomowa do mikromacierzy) i NGS (ang. next-generation sequencing, sekwencjonowanie nowej generacji) [9]. Obecnie, tylko niewielka grupa chorób rzadkich o podłożu genetycznym (80% wszystkich chorób rzadkich) jest diagnozowana badaniami genetycznymi objętymi koszykiem świadczeń gwarantowanych. Chodzi o klasyczne metody cytogenetyki, sekwencjonowanie metodą Sangera, MLPA (ang. Multiplex Ligation-dependent Probe Amplification), FISH (ang. fluorescent in situ hybrydization, fluorescencyjna hybrydyzacja in situ) oraz PCR.
I chociaż koszt jednostkowy badania testami aCGH i NGS przewyższa koszt badań już objętych refundacją, to łączny koszt diagnostyki choroby rzadkiej u danego pacjenta jest przy ich zastosowaniu niższy dzięki szybkiemu ustaleniu rozpoznania i uniknięciu odysei diagnostycznej, która może trwać latami. Skutkuje to tym, że pacjenci często otrzymują diagnozę dopiero, gdy choroba już jest bardzo rozwinięta, a jej stopień nasilenia uniemożliwia skuteczną terapię. Oprócz diagnostyki, poważnymi problemami są również: brak rejestru chorób, mała liczba specjalistycznych ośrodków oraz niewystarczająca edukacja pacjentów i lekarzy.
Warto nadmienić, iż począwszy od 2021 roku w Polsce funkcjonuje Plan dla Chorób Rzadkich. Program ten zakłada wprowadzenie badań genomowych w zakresie niezbędnym w procesie diagnostyki i monitorowania leczenia pacjentów z wybranymi chorobami rzadkimi, powołanie ośrodków eksperckich oraz strwożenie rejestru chorób rzadkich, który do tej pory nie istniał [10]. W założeniu plan ma poprawić sytuację osób chorych i podnieść standardy diagnostyki i leczenia na wzór europejski.
Podsumowanie
Setki tysięcy osób w Polsce boryka się z chorobami rzadkimi, których prawidłowa diagnostyka oraz leczenie jest poważnym wyzwaniem dla systemu opieki zdrowotnej. Wiąże to przede wszystkim z bardzo niską częstotliwością występowania, co w konsekwencji wpływa na ograniczoną wiedzą środowiska medycznego w tym zakresie. Sytuacja ta w najbliższym czasie może ulec jednak znacznej poprawie dzięki realizacji Planu dla Chorób Rzadkich, który zakłada wprowadzenie badań genomowych, powołanie ośrodków eksperckich oraz opracowanie nowych kryteriów wniosków w ramach programów lekowych. Niemniej jednak należy podkreślić, iż nie sam plan, lecz jego skuteczna realizacja może poprawić sytuacje dotkniętych chorobami rzadkimi oraz ich rodzin.
Autor:
Oleksandr Shtyka
Koordynator ds. współpracy międzynarodowej
Key Products Department Urtica Sp. z o.o.
Piśmiennictwo
- European Commission, „Rare diseases,” 2023. [Online]. Available: https://research-and-innovation.ec.europa.eu/research-area/health/rare-diseases_en.
- EURORDIS- Rare Diseases Europe, 2023. [Online]. Available: https://www.eurordis.org/.
- Ministerstwo Zdrowia, „Narodowy Plan dla Chorób Rzadkich,” 2019.
- Sean, „The Process and Costs of Drug Development (2022),” FTLOScience, 2022.
- M. M. J. L. O. Wouters, „Estimated Research and Development Investment Needed to Bring a New Medicine to Market, 2009-2018,” JAMA, 2019.
- European Medicines Agency, „Rare diseases, orphan medicines,” 2018.
- Zamora et al., „Comparing access to orphan medicinal,” Orphanet journal of rare diseases, 2019.
- Agencja Oceny Technologii Medycznych i Taryfikacji, „Ocena wniosków dotyczących leków stosowanych w chorobach rzadkich w praktyce AOTMiT w latach 2012-2019.,” 2019.
- Termedia, „Choroby rzadkie wymagają zmian systemowych. Rekomendacje RPO,” 2022. [Online]. Available: https://www.termedia.pl/neurologia/Choroby-rzadkie-wymagaja-zmian-systemowych-Rekomendacje-RPO,48091.html.
- Ministerstwo Zdrowia, „Plan dla Chorób Rzadkich,” 2021.
Artykuł został opublikowany na łamach 57. wydania kwartalnika „Farmakoekonomiki Szpitalnej", którego jesteśmy wydawcą. Czasopismo jest skierowane do pracowników farmacji szpitalnej.
Przypominamy, że można go otrzymać w formie bezpłatnej prenumeraty.
DOŁĄCZ DO GRONA PRENUMERATORÓW!