Lecanemab – kamień milowy w walce z chorobą Alzheimera?
Czy Lecanemab stanie się nową nadzieją w walce z chorobą Alzheimera?
Zmiany strukturalne i funkcjonalne zachodzące w mózgu osób starszych ściśle korelują ze zmianami poznawczymi związanymi z fizjologicznym procesem starzenia (tj. pogorszenie pamięci, koncentracji, uwagi). Niewątpliwie zmiany te są zdecydowanie bardziej nasilone podczas przebiegu choroby Alzheimera (AD, ang. Alzheimer’s disease). Znaczne deficyty bieżącej pamięci u pacjentów z AD utrudniają im wykonywanie codziennych czynności, a z czasem prowadzą do ich całkowitego zaniechania. Niewątpliwie ta wieloczynnikowa choroba stanowi istotne wyzwanie zdrowotne naszych czasów. Rosnące znaczenie epidemiologiczne AD jest bezpośrednio związane z globalnym trendem demograficznym, którym jest wydłużanie życia oraz wzrost liczby osób w wieku podeszłym. Przedmiotowa jednostka chorobowa stanowi ogromne obciążenie zarówno dla systemów opieki zdrowotnej, jak również dla pacjentów i ich rodzin. Przełomowym krokiem w farmakoterapii AD może okazać się decyzja Komisji Europejskiej z kwietnia 2025 roku, tj. wydanie zgody na dopuszczenie do obrotu lecanemabu – przeciwciała monoklonalnego mAb158 przeznaczonego do leczenia wczesnego, tzw. prodromalnego stadium tej choroby. Jest to pierwsza terapia przyczynowa na terenie UE ukierunkowana na amyloid (ATT, ang. amyloid targeting therapies, ATT), odkładający się w mózgu pacjentów z AD. Bezpośredni mechanizm działania lecanemabu jest skierowany przeciwko zagregowanym rozpuszczalnym i nierozpuszczalnym formom beta-amyloidu, które to okazały się bardziej toksyczne dla neuronów niż monomery lub nierozpuszczalne fibryle.
SŁOWA KLUCZOWE
lecanemab, choroba Alzheimera, zaburzenia procesów poznawczych, amyloid, terapie ukierunkowane na amyloid
ROZPOWSZECHNIENIE CHORÓB OTĘPIENNYCH
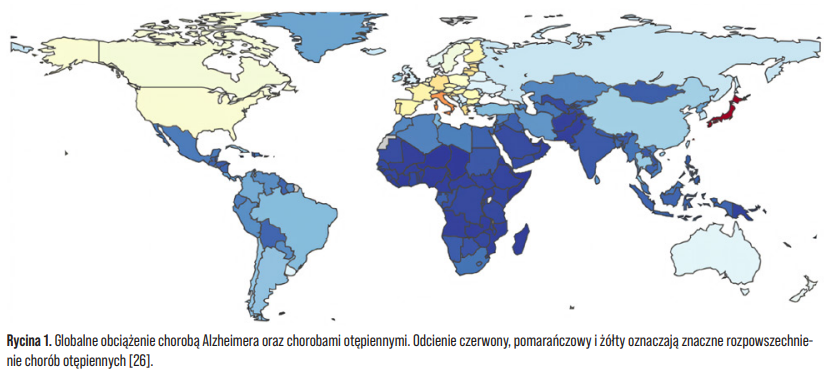
Odsetek osób starszych na świecie wciąż sukcesywnie wzrasta. Według danych Światowej Organizacji Zdrowia (WHO, ang. World Health Organization) w 2020 roku liczba osób w wieku 60 lat i starszych wynosiła około 1 miliarda, a do 2030 r. szacuje się, że wzrośnie ona do 1,4 miliarda [1]. Zjawisko starzenia się społeczeństwa dotyczy także naszego kraju. W Polsce pod koniec 2023 r. liczba osób w wieku 60 lat oraz starszych wyniosła aż 9,9 mln [2]. Szacunkowe dane wskazują, iż około 7% populacji po 60. r.ż. cierpi na chorobę Alzheimera (AD, ang. Alzheimer’s disease). Niestety rozpowszechnienie chorób otępiennych, w tym otępienia alzheimerowskiego, wzrasta w kolejnych dekadach życia. Obecne prognozy demograficzne przewidują aż trzykrotny wzrost liczby rozpoznań AD do roku 2050. W związku z powyższym można wysunąć wniosek, iż AD stanowi poważne wyzwanie zdrowotne XXI wieku [3, 4].
ZABURZENIA POZNAWCZE A CHOROBA ALZHEIMERA
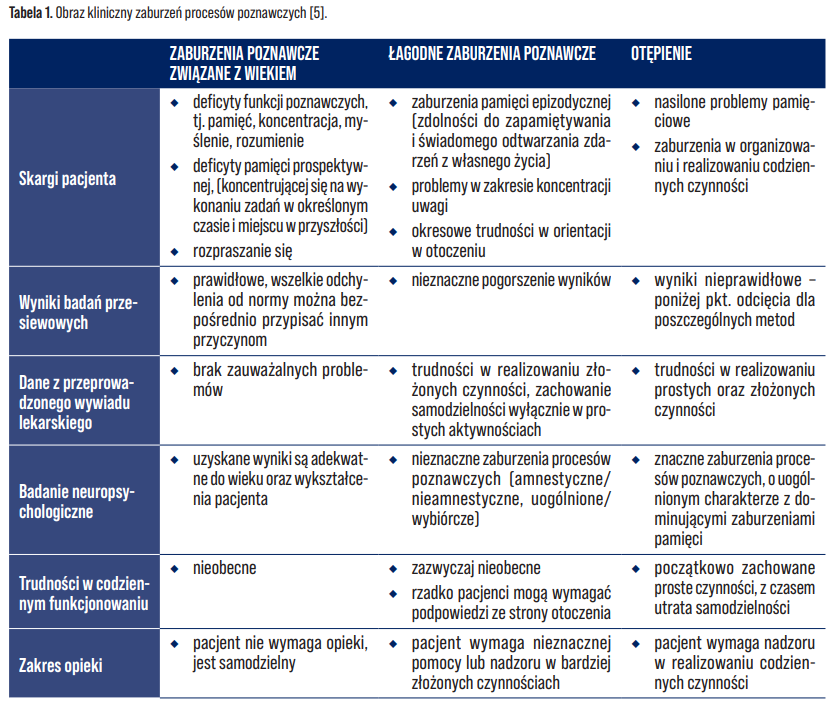
Proces starzenia jest zjawiskiem fizjologicznym, któremu często towarzyszą zmiany w funkcjonowaniu poznawczym. Ich nasilenie może przyjmować różne formy – od typowego, fizjologicznego osłabienia zdolności poznawczych związanego z wiekiem, przez subiektywnie odczuwane pogorszenie, aż po uchwytne klinicznie łagodne zaburzenia poznawcze (MCI, ang. mild cognitive impairment), które to u części osób (ok. 5–17%) mogą prowadzić do rozwoju choroby otępiennej [5]. W tabeli 1. przedstawiono obraz kliniczny zaburzeń procesów poznawczych.
Biorąc pod uwagę rosnącą populację osób starszych i znaczenie funkcji poznawczych w utrzymaniu niezależności funkcjonalnej i skutecznej komunikacji z innymi, ważne jest zrozumienie, iż funkcje te pogarszają się sukcesywnie wraz z postępującym wiekiem. Zaburzenia funkcji poznawczych manifestują się obniżoną zdolnością do podzielności uwagi, trudnościami w przyswajaniu nowych informacji, osłabieniem pamięci werbalnej, redukcją płynności językowej oraz deficytami w zakresie funkcji wykonawczych. Natomiast pamięć semantyczna, proceduralna czy spostrzeganie są zachowane na odpowiednim poziomie u pacjentów w wieku podeszłym [5, 6].
AD to nieodwracalne, stopniowo postępujące schorzenie neurozwyrodnieniowe ośrodkowego układu nerwowego (CNS, ang. central nervous system) [7, 8]. Schorzenie to stanowi najczęstszą przyczynę otępień na świecie, gdyż uwzględniając jej postacie mieszane, odpowiada za niemalże 75% wszystkich rozpoznanych zespołów otępiennych. Choć przedmiotowe schorzenie cechuje się heterogennością pod względem etiopatogenezy i obrazu klinicznego, to w praktyce klinicznej zdecydowanie przeważa postać sporadyczna, występująca głównie u pacjentów powyżej 65. roku życia, z przewagą deficytów pamięci epizodycznej jako objawu dominującego. W chorobie Alzheimera proces neurodegeneracyjny rozpoczyna się zazwyczaj na wiele lat, często nawet kilkadziesiąt, przed pojawieniem się wyraźnych objawów klinicznych otępienia. Przedmiotowa jednostka chorobowa rozwija się stopniowo, posiada charakter postępujący, a jej wczesne symptomy bywają trudne do uchwycenia zarówno dla otoczenia chorego, jak i dla mniej doświadczonych specjalistów. Pierwsze objawy AD zwykle obejmują pogarszającą się pamięć bieżącą, co znacząco utrudnia codzienne funkcjonowanie pacjenta. Zaburzenia te są nazywane mianem deficytów pamięci epizodycznej i manifestują się trudnościami w przyswajaniu oraz trwałym zapamiętywaniu nowych informacji, a także niemożnością ich późniejszego odtworzenia, nawet mimo uzyskania podpowiedzi. Osoby z najbliższego otoczenia często zwracają uwagę na powtarzanie przez chorego tych samych pytań, wypowiedzi, historii czy wykonywanie pewnych czynności wielokrotnie [8]. W przebiegu tej choroby szybko mogą rozwinąć się także zmiany nastroju, osobowości czy zachowania. Z czasem u pacjentów pojawiają się także objawy, tj. zaburzenia funkcji wykonawczych, afazja (zaburzenia mowy), apraksja (upośledzenie precyzyjnych celowych ruchów przy braku niedowładu, objawów móżdżkowych czy zaburzeń czucia) i agnozja (nieprawidłowe rozpoznawanie bodźców mimo prawidłowego funkcjonowania narządów zmysłów) [3, 9].
ZMIANY OBSERWOWANE W MÓZGU PODCZAS FIZJOLOGICZNEGO PROCESU STARZENIA ORAZ W PRZEBIEGU AD
Zdrowy, a zatem prawidłowo funkcjonujący mózg osoby dorosłej wyposażony jest w miliardy neuronów, które to za pośrednictwem synaps kontaktują się między sobą, tworząc sieci neuronowe. Informacje od neuronów są odbierane przez synapsy położone na dendrytach, następnie przewodzone wzdłuż neuronu i przekazywane dalej do synaps na zakończeniach aksonu. W takich połączeniach, zwanych synapsami, informacje przepływają w postaci maleńkich serii substancji chemicznych,
które są uwalniane przez jeden neuron i dalej pobierane przez drugi. Sygnały te są podstawą wspomnień, myśli, wrażeń, emocji, ruchów i umiejętności [6, 9-10]. Niestety w mózgu osób starszych zachodzą zmiany zarówno strukturalne, jak również funkcjonalne, które bezpośrednio korelują ze zmianami poznawczymi związanymi z wiekiem (m.in. są to zmiany w strukturze neuronowej bez obumierania neuronów, utrata synaps oraz dysfunkcja sieci neuronowych )[6].
Liczne zmiany zachodzące w mózgu mogą zakłócać sygnalizację chemiczną, a tym samym prowadzić do rozwoju zaburzeń procesów poznawczych, które to pojawiają się w przebiegu AD. Badacze obecnie wyróżniają dwie główne hipotezy dotyczące rozwoju AD, tj. hipoteza cholinergiczna i hipoteza amyloidowa. Do zmian obserwowanych w obrębie mózgu w przebiegu AD można zaliczyć: gromadzenie się fragmentu białka beta-amyloidu (Aβ, ang. amyloid beta) w tzw. grudki (zwane również blaszkami beta-amyloidu) na zewnątrz neuronów, jak również gromadzenie się nieprawidłowej formy białka tau (zwanej splątkami tau) wewnątrz neuronów. Aβ i białko tau odgrywają różne role w chorobie Alzheimera. Blaszki i mniejsze nagromadzenia Aβ mogą uszkadzać neurony, zakłócając w ten sposób komunikację neuron-neuron w synapsach. Natomiast wewnątrz neuronów splątki tau blokują transport składników odżywczych i innych cząsteczek niezbędnych do prawidłowego funkcjonowania i przeżycia neuronów, tym samym uszkadzają także połączenia między nimi. Akumulacja Aβ i białka tau prowadzi nie tylko do uszkodzenia i zniszczenia neuronów (tzw. neurodegeneracji), ale także innych komórek mózgowych [9]. Inną charakterystyczną zmianą w mózgu występującą w przebiegu AD jest atrofia, a mianowicie zmniejszenie objętości mózgu wynikające, m.in. z procesu neurodegeneracji. Należy mieć na uwadze, iż zjawisko atrofii jest również bezpośrednio związane z fizjologicznym procesem starzenia. Niemniej, u pacjentów z AD atrofia jest znacznie przyśpieszona [6, 9].
Wiele przeprowadzonych dotychczas badań wykazuje, iż utrata neuronów podczas fizjologicznego procesu starzenia jest ograniczona wyłącznie do określonych obszarów układu nerwowego i nie przekracza 10% neuronów występujących u młodych osób dorosłych [6, 11-12]. Utrata neuronów korowych jest najbardziej zauważalna w grzbietowo-bocznej korze przedczołowej i hipokampie, a większą podkorową utratę neuronów można zaobserwować w istocie czarnej i móżdżku. AD jest związana ze znacznie większą utratą neuronów, szczególnie w hipokampie i korze entorhinalnej [6, 11-13]. Warto zaznaczyć, iż w przeciwieństwie do AD podczas fizjologicznego procesu starzenia znaczna liczba neuronów jedynie zmienia swoją strukturę, ale nie obumiera. Ponadto utrata synaps jest kluczowym strukturalnym markerem starzenia się układu nerwowego [6, 13-14]. Wyniki przeprowadzonych dotychczas badań nad otępieniem sugerują, iż demencja objawowa występuje, gdy dochodzi do co najmniej 40% lub większej utraty synaps kory nowej w porównaniu ze zdrowymi dorosłymi [6, 13]. Zatem neurodegeneracja prowadząca do atrofii wraz z akumulacją białka tau i białka Aβ oraz utratą synaps są uznawane za kluczowe czynniki leżące u podstawy AD.
LECZENIE AD
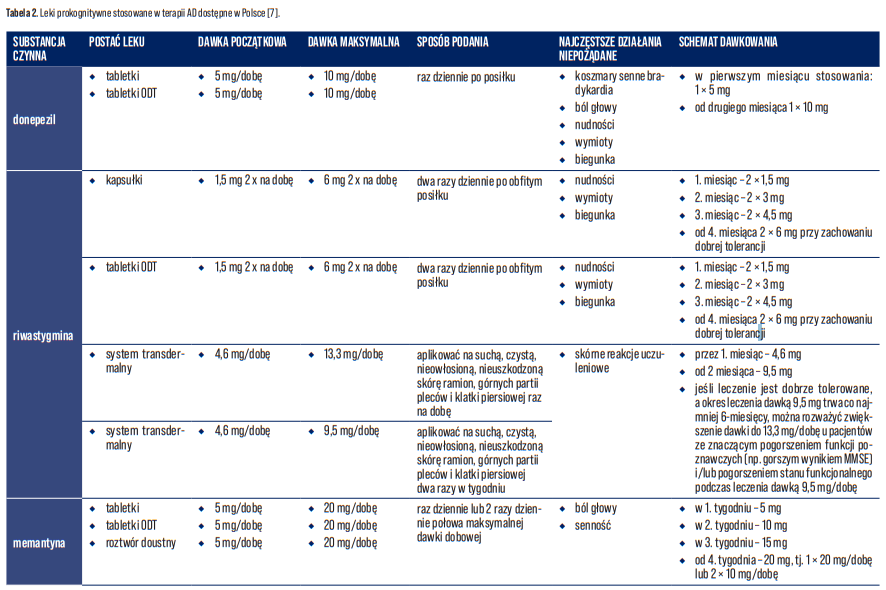
Obecnie na polskim rynku farmaceutycznym istnieją wyłącznie dwie klasy zatwierdzonych leków w farmakoterapii AD, a mianowicie inhibitory enzymu cholinoesterazy (tj. donepezyl, rywastygmina) i antagoniści N-metylo-D-asparaginianu (NMDA) (tj. memantyna), które są skuteczne wyłącznie w leczeniu objawów AD. Niestety nie leczą one przyczyny ani nie zapobiegają chorobie. W Polsce inhibitory enzymu cholinoesterazy są zarejestrowane do leczenia otępienia o łagodnym i umiarkowanym nasileniu. Niemniej są one również stosowane na dalszych etapach choroby, z tym, że nie są już objęte refundacją. Natomiast memantyna jest wskazana w leczeniu umiarkowanych i ciężkich postaci AD. W tabeli 2. zestawiono leki prokognitywne stosowane w terapii AD [7].
Prowadzone obecnie badania koncentrują się na zrozumieniu patologii AD poprzez ukierunkowanie na kilka czynników, takich jak nieprawidłowy metabolizm białka tau, β-amyloid, odpowiedź zapalna oraz uszkodzenia cholinergiczne i wolnorodnikowe, mając na celu opracowanie skutecznych metod leczenia, które byłyby w stanie zatrzymać lub zmodyfikować postęp przedmiotowej jednostki chorobowej. Dotychczas Amerykańska Agencja ds. Żywności i Leków (FDA, ang. Food and Drug Administration) zatwierdziła dwa nowe leki prokognitywne, a mianowicie przeciwciała monoklonalne, tj. aducanumab (rejestracja warunkowa) i lekanemab. Cząsteczki te celują w Aβ [7].
LECANEMAB – NOWE PODEJŚCIE W LECZENIU CHOROBY ALZHEIMERA?
Lecanemab został zatwierdzony nie tylko przez FDA, ale również przez organy regulacyjne w Chinach, Hongkongu, Izraelu, Japonii i Korei Południowej. Na szczególną uwagę zasługuje fakt, iż Komisja Europejska po ponownym rozpatrzeniu wniosku odrzuconego w 2024 r., w dniu 14 kwietnia 2025 r. wydała pozwolenie na dopuszczenie do obrotu na terenie Unii Europejskiej produktu leczniczego Leqembi zawierającego w swoim składzie lecanemab [15]. Oznacza to, iż produkt leczniczy zawierający tą specyficzną cząsteczkę białka w najbliższym czasie najprawdopodobniej pojawi się również w Polsce.
Lecanemab jest lekiem immunosupresyjnym, podawanym za pomocą infuzji dożylnych. Wskazanie do stosowania produktu leczniczego Leqembi obejmuje leczenie dorosłych pacjentów z klinicznym rozpoznaniem łagodnego upośledzenia funkcji poznawczych (MCI due to AD, ang. mild cognitive impairment due to AD) i łagodnego otępienia spowodowanych AD (wczesna AD), nie będących nosicielami genu apolipoproteiny E ε4 (ApoE ε4) lub niebędących heterozygotami z potwierdzoną patologią amyloidu [15]. Warto podkreślić, że byłby to pierwszy lek na polskim rynku, który we wskazaniach obejmowałby pacjentów z MCI spowodowanymi wczesną postacią AD. Ponadto byłby to pierwszy lek o działaniu przyczynowym.
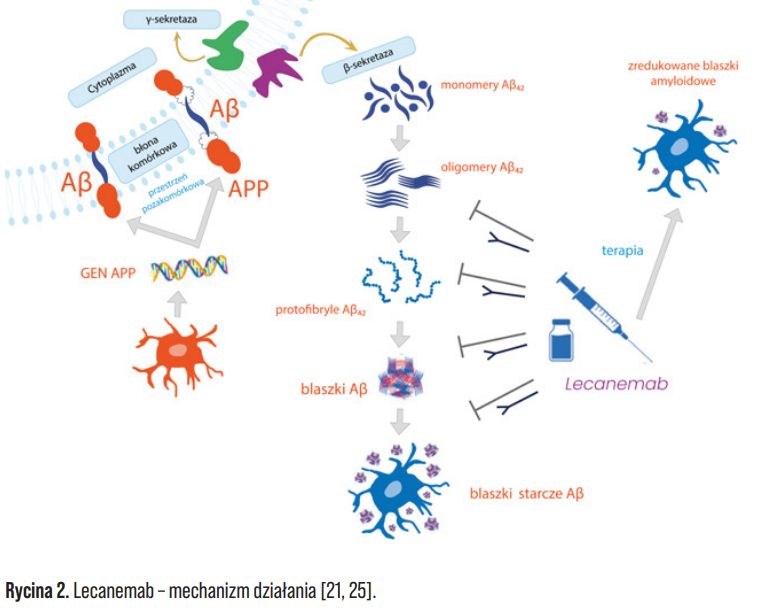
Lek ten jest zaliczany do tzw. terapii ukierunkowanych na amyloid (ATT, ang. amyloid targeting therapies), a zatem jego mechanizm działania jest skierowany na przyczynę przedmiotowej choroby. Przeciwciało monoklonalne IgG1, lecanemab, jest skierowane przeciwko zagregowanym rozpuszczalnym i nierozpuszczalnym formom beta-amyloidu (Ryc. 2), które to są bardziej toksyczne dla komórek nerwowych niż monomery lub nierozpuszczalne fibryle. Lecanemab oddziałuje na rozpuszczalne protofibryle Aβ, które są prekursorami nierozpuszczalnych blaszek amyloidu. Na skutek swojego działania zmniejsza blaszki Aβ oraz usuwa złogi tego białka z mózgu osób chorych. Mechanizm działania lecanemabu jest szczególnie cenny, gdyż gromadzenie się rozpuszczalnych i nierozpuszczalnych agregatów Aβ może inicjować lub nasilać procesy patologiczne w chorobie Alzheimera [15-17].
DAWKOWANIE
Zalecana dawka lecanemabu to 10 mg/kg masy ciała podawana we wlewie dożylnym raz na 2 tygodnie. Leczenie z wykorzystaniem preparatu Leqembi należy przerwać, gdy u pacjenta nastąpi progresja do choroby Alzheimera o nasileniu umiarkowanym. Zatem zalecane jest przeprowadzanie przez lekarza specjalistę badania funkcji poznawczych i oceny objawów klinicznych co około 6 miesięcy podczas terapii lecanemabem. Wyniki uzyskane w ramach przeprowadzonych badań, a także informacje odnośnie do nasilenia objawów powinny być wykorzystane do wykonania oceny, czy u pacjenta nastąpiła progresja do umiarkowanego otępienia typu alzheimerowskiego i/lub czy przebieg kliniczny może wskazywać, iż lecanemab nie wykazał skuteczności u pacjenta, a także w celu podjęcia decyzji, czy nie należy przerwać leczenia lecanemabem.
SKUTECZNOŚĆ ORAZ BEZPIECZEŃSTWO STOSOWANIA LECANEMABU
W celu potwierdzania skuteczności i bezpieczeństwa stosowania lecanemabu u pacjentów z wczesną postacią AD przeprowadzono badanie kliniczne Clarity AD, które to było 18-miesięcznym (badanie podstawowe) wieloośrodkowym, podwójnie zaślepionym, kontrolowanym placebo, badaniem Core w grupach równoległych z otwartym rozszerzeniem (OLE). Zrekrutowani uczestnicy zostali zrandomizowani do 2 grup przyjmujących placebo lub lecanemab (stosowany w następującym schemacie: 10 mg/kg co dwa tygodnie). W badaniu wzięło udział 1795 uczestników z Core i 1612 uczestników z co najmniej jedną dawką lecanemabu (Core + OLE). Ocena bezpieczeństwa obejmowała monitorowanie parametrów życiowych, badania fizykalne, zdarzenia niepożądane, parametry badań laboratoryjnych, elektrokardiogramy. Przez cały okres trwania badania za pomocą rezonansu magnetycznego monitorowano (MRI, ang. magnetic resonance imaging) występowanie radiologicznych nieprawidłowości związanych z amyloidem (ARIA, ang. amyloid-related imaging abnormalities). Głównym miernikiem skuteczności była zmiana objawów po 18 miesiącach, mierzona za pomocą skali oceny demencji znanej jako CDR-SB (ang. Clinical Dementia Rating-Sum-of-Boxes). Skala CDR-SB jest stosowana u pacjentów do oceny ciężkości AD. Obejmuje ona pytania, które pomagają określić, w jakim stopniu codzienne życie pacjenta zostało dotknięte upośledzeniem funkcji poznawczych. Skala ma zakres od 0 do 18, przy czym wyższe wyniki wskazują na większe upośledzenie [18].
W badaniu Clarity AD zmiana od wartości początkowej dla lecanemabu w podstawowym wyniku punktacji Clinical Dementia Rating-Sum-of-Boxes (CDR-SB) była mniejsza niż w przypadku placebo po 18 miesiącach stosowania, przy czym wszystkie kluczowe drugorzędne wyniki kliniczne wspierały wynik główny [18]. Dane uzyskane z globalnego, kontrolowanego placebo, podwójnie zaślepionego, z grupami równoległymi, randomizowanego badania klinicznego 3. fazy Clarity AD firmy Eisai wykazały, iż Leqembi spowalnia spadek funkcji poznawczych u pacjentów z wczesną chorobą Alzheimera w porównaniu z placebo [18]. W przeciwieństwie do kontrowersyjnego badania klinicznego 3. fazy aducanumabu, badanie fazy 3. lecanemabu wyraźnie wykazało jego skuteczność w łagodzeniu pogorszenia funkcji poznawczych. Lecanemab wiąże drobne protofibryle ze 100-krotnie większym powinowactwem niż aducanumab i duże protofibryle z 25-krotnie większym powinowactwem. Wykazuje on znacznie niższe powinowactwie do monomerów [19-21]. Ponadto późniejsze badania wykazały, iż lecanemab jest również skuteczny w wydłużaniu okresu utrzymywania się MCI, co tym samym spowolnia rozwój AD [19-22].
Drugą niezwykle istotną kwestią jest bezpieczeństwo stosowania przedmiotowego leku. ARIA należą do najczęstszych działań niepożądanych lekanemabu. Obrzęk mózgu (ARIA-E) wystąpił odpowiednio u 12,6% i 1,7% uczestników badania. Inne zgłaszane działania niepożądane przez pacjentów obejmowały bóle głowy (11,1% w grupie lekanemabu vs 8,1% w placebo) oraz upadki (10,4% vs 9,6%). W zdecydowanej większości przypadków obrzęki mózgu miały przebieg łagodny lub umiarkowany (91%), były bezobjawowe (78%), pojawiały się w ciągu pierwszych trzech miesięcy terapii (71%) i ustępowały w ciągu czterech miesięcy od wykrycia (81%). Objawowe ARIA-E odnotowano u 2,8% pacjentów otrzymujących lecanemab; najczęściej zgłaszanymi objawami były ból głowy, zaburzenia widzenia oraz splątanie. Krwawienia odnotowano u 17,3% pacjentów otrzymujących lecanemab oraz u 9% stosujących placebo. Częstość występowania izolowanych przypadków ARIA-H (ograniczonych do krwawienia) wynosiła 8,9% w grupie lekanemabu i 7,8% w grupie placebo, a dominującym objawem klinicznym były zawroty głowy [23].
W przypadku przedmiotowej cząsteczki występowanie ARIA-E jest zależne od dawki. Ponadto zwiększona częstość występowania jest bezpośrednio powiązana z allelem ε4 genu ApoE, co jest profilem podobnym do obserwowanego w przypadku bapineuzumabu, donanemabu, gantenerumabu i aducanumabu. Zaleca się zachowanie wzmożonej czujności klinicznej w przypadku ARIA w ciągu pierwszych 14 tygodni leczenia terapią antyamyloidową. Szczegółowe wskazówki dotyczące monitorowania zawarto w zatwierdzonych drukach informacyjnych (ChPL, ulotka) lecanemabu [23]. Należy wykonać badanie MRI przed 5., 7. i 14. infuzją. Jak wskazano w ChPL oraz ulotce lecanemabu, jeśli u uczestnika występują objawy sugerujące ARIA, należy przeprowadzić ocenę kliniczną, w tym skanowanie MRI, jeśli jest wskazane. Chociaż ARIA-E najprawdopodobniej wystąpi na wczesnym etapie terapii, mogą pojawić się także późne zdarzenia, dlatego zawsze zaleca się zachowanie czujności w przypadku wystąpienia podejrzanych objawów w trakcie prowadzenia terapii. Ze względu na to, że u uczestników przyjmujących lecanemab obserwowano krwotok śródmózgowy, należy zachować dodatkową ostrożność, rozważając stosowanie lecanemabu z lekami przeciwzakrzepowymi lub lekiem trombolitycznym [18]. Produkt leczniczy Leqembi jest przeciwskazany do stosowania wśród pacjentów z nadwrażliwością na substancję czynną lub substancje pomocnicze, a także u pacjentów z zaburzeniami krzepnięcia, które nie są wystarczająco kontrolowane. Ponadto przeciwskazaniem do stosowania przedmiotowej terapii jest zaobserwowanie przed leczeniem w badaniu MRI wcześniejszego krwotoku śródmózgowego, więcej niż 4 mikrokrwotoków, syderozy powierzchownej lub obrzęku naczynioruchowego albo innych objawów sugerujących mózgową angiopatię amyloidową [15].
W przeprowadzonym badaniu klinicznym 3. fazy lecanemab był ogólnie dobrze tolerowany przez pacjentów włączonych do badania, a najczęstszymi działaniami niepożądanymi były reakcje związane z infuzją, ARIA-H, ARIA-E. Należy podkreślić, iż w przypadku starannej kwalifikacji chorych z MCI lub łagodnym otępieniem alzheimerowskim do terapii ukierunkowanej na amyloid oraz przy zastosowaniu odpowiedniego monitorowania w trakcie leczenia ryzyko wystąpienia zmian typu ARIA może być przewidywalne i odpowiednio kontrolowane. Prawidłowa kwalifikacja pacjentów, oparta m.in. na analizie uwarunkowań genetycznych (w tym obecności alleli ApoE ε4) oraz wynikach zaawansowanych badań neuroobrazowych, znacznie ogranicza ryzyko wystąpienia powikłań związanych ze stosowaniem lecanemabu, a tym samym zwiększa profil bezpieczeństwa przedmiotowej terapii.
PODSUMOWANIE
Przeprowadzone badanie 3. fazy wykazało, iż lecanemab spowalnia progresję łagodnych zaburzeń poznawczych spowodowanych AD oraz wczesnego stadium otępienia alzheimerowskiego o 27%. Zatem decyzja Komisji Europejskiej sprawiła, iż lecanemab stał się pierwszą opcję terapeutyczną w Unii Europejskiej ukierunkowaną na spowolnienie progresji wczesnej postaci AD. Choć lek ten nie daje możliwości całkowitego wyleczenia AD, to należy mieć na uwadze, iż lecanemab jako terapia ATT powoduje opóźnienie progresji objawów choroby o około 2-3 lata. Ta przełomowa decyzja w sprawie dopuszczenia do obrotu lecanemabu na terenie UE, pierwszego leku działającego bezpośrednio na przyczynę AD, daje ogromną nadzieję pacjentom na spowolnienie postępu choroby. Powyższe stanowi przełomowy etap w procesie udostępniania leczenia pacjentom spełniającym kryteria kwalifikacyjne [15-17].
Choć stosowanie lecanemabu wiąże się z określonym ryzykiem, może ono zostać istotnie ograniczone dzięki zastosowaniu nowoczesnych metod diagnostycznych, w tym neuroobrazowania oraz analiz genetycznych. W szczególności konieczne jest oznaczanie wariantu genu kodującego apolipoproteinę E4 (ApoE4) oraz wykonywanie rezonansu magnetycznego z oceną obecności mikrokrwawień śródmózgowych. Niewątpliwie kluczowym elementem terapii jest odpowiednie przygotowanie opieki zdrowotnej do wdrażania strategii wczesnej diagnostyki. Wobec powyższego konieczne jest opracowanie i implementacja kompleksowego, szeroko zakrojonego programu diagnostycznego, który umożliwiłby zdiagnozowanie wczesnej postaci otępienia alzheimerowskiego oraz stanów przed otępiennych (tj. MCI) na etapie ambulatoryjnym. Na skutek wdrożenia krajowego programu przeciwdziałania chorobom otępiennym, którego celem będzie ujednolicenie działań edukacyjnych, prewencyjnych oraz terapeutycznych, może nastąpić intensyfikacja powyższych założeń. Zgodnie z zapowiedziami Ministerstwa Zdrowia, ma on zostać przyjęty i oficjalnie opublikowany w 2025 r.
dr n. farm. Agnieszka Zajda-Ambroszczyk
przemysł farmaceutyczny
Piśmiennictwo
-
Strona internetowa: https://www.who.int/news-room/fact-sheets/detail/ageing-and-health (dostęp: 31.05.2025).
-
Wyszkowska D, Gabińska M, Romańska S. Główny Urząd Statystyczny, Urząd Statystyczny w Białymstoku. Sytuacja osób starszych w Polsce w 2023 r. Warszawa, Białystok: 2024., s. 10.
-
Parnowski T, Borzym A, Broczek K, Mastalerz-Migas A, Szafrański T. Rekomendacje leczenia pobudzenia u chorych z otępieniem dla lekarzy POZ. Lekarz POZ. 2018;4:239–
-
Bugaj A, Jermakow N. Mechanizmy leżące u podłoża choroby Alzheimera. Neuropsychiatria i Neuropsychologia. 2016;11(3):85–92.
-
Barczak A. Pogorszenie funkcji poznawczych związane z wiekiem. Medycyna po dyplomie (Geriatria). 2023;1:1–
-
Murman DL. The Impact of Age on Cognition. Semin Hear. 2015;36(3):111–21.
-
Klimkowicz-Mrowiec A. Leczenie choroby Alzheimera. Aktualności Neurologiczne. 2023;23(4):145–150.
-
Barczak A. Wczesne rozpoznanie choroby Alzheimera – wskazówki dla lekarza POZ. Lekarz POZ. 2022;1:57–
-
2024 Alzheimer's disease facts and figures. Alzheimers Dement. 2024;20(5):3708–3821.
-
Zarębski Ł, Wrzos A, Sowa-Kućama M. Jak neurony kontrolują aktywność mózgu? Znaczenie dynamiki zmian w pobudzającej synapsie glutaminergicznej. Wszechświat. 2020;t.121(nr 4–6):127–
-
Pannese E. Morphological changes in nerve cells during normal aging. Brain Struct Funct. 2011;216(2):85–89.
-
Morrison JH, Hof PR. Life and death of neurons in the aging brain. Science. 1997;278(5337):412–419.
-
Terry RD, Masliah E, Salmon DP. et al. Physical basis of cognitive alterations in Alzheimer's disease: synapse loss is the major correlate of cognitive impairment. Ann Neurol. 1991;30(4):572–580.
-
Masliah E, Mallory M, Hansen L, DeTeresa R, Terry R D. Quantitative synaptic alterations in the human neocortex during normal aging. Neurology. 1993;43(1):192–197.
-
CHPL Leqembi, 2025 (https://www.ema.europa.eu/en/medicines/human/EPAR/leqembi).
-
Strona internetowa: Termedia – https://www.termedia.pl/neurologia/Pierwszy-lek-na-alzheimera-dopuszczony-do-obrotu-przez-KE,61376.html (dostęp: 01.06.2025).
-
Honig L, Sabbagh M, van Dyck C, Sperling R, Hersch S, Matta A., et al. Updated safety results from phase 3 lecanemab study in early Alzheimer's disease. Alzheimers Res Ther. 2024; 10;16(1):105.
-
Honig LS, Sabbagh MN, van Dyck CH, Sperling RA, Hersch S, Matta A. et al. Updated safety results from phase 3 lecanemab study in early Alzheimer's disease. Alzheimers Res Ther. 2024; 10;16(1):105. doi: 10.1186/s13195-024-01441-8.
-
Khartabil N, Awaness A. Targeting Amyloid Pathology in Early Alzheimer’s: The Promise of Donanemab-Azbt. Pharmacy. 2025;13:23.
-
Yang Y, Qiu L. Research Progress on the Pathogenesis, Diagnosis, and Drug Therapy of Alzheimer’s Disease. Brain Sci. 2024, 14(6); 590.
-
Chowdhury S, Chowdhury NS. Novel anti-amyloid-beta (Aβ) monoclonal antibody lecanemab for Alzheimer’s disease: A systematic review. J. Immunopathol. Pharmacol. 2023;37: 03946320231209839.
-
Monfared, AAT, Tafazzoli A, Ye W, Chavan A, Zhang Q.. Long-Term Health Outcomes of Lecanemab in Patients with Early Alzheimer’s Disease Using Simulation Modeling. Ther. 2022;11(2):863–880.
-
van Dyck CH, Swanson CJ, Aisen P. et al. Lecanemab in early Alzheimer’s disease. N Engl J Med. 2023;388:9–21.
-
Strona internetowa: https://www.termedia.pl/neurologia/Potrzebny-system-wczesnego-wykrywania-zaburzen-pamieci,58892.html (dostęp: 01.06.2025).
-
Rycina przygotowana za pomocą: https://BioRender.com.
-
Javaid SF, Giebel C, Khan MA and Hashim MJ. Epidemiology of Alzheimer’s disease and other dementias: rising global burden and forecasted trends. F1000Research. 2021;10:425.
Powyższy artykuł został opublikowany na łamach 64. wydania kwartalnika „Farmakoekonomiki Szpitalnej". Czasopismo, skierowane do pracowników farmacji szpitalnej, można otrzymać w formie bezpłatnej prenumeraty.